分散系:分散质+分散剂
鉴别胶体与溶液:丁达尔效应
当一束光通过胶体时,形成一条光亮的“通路”,这是胶体粒子对光线散射造成的
能透过滤纸:溶液、胶体
能透过半透膜:溶液
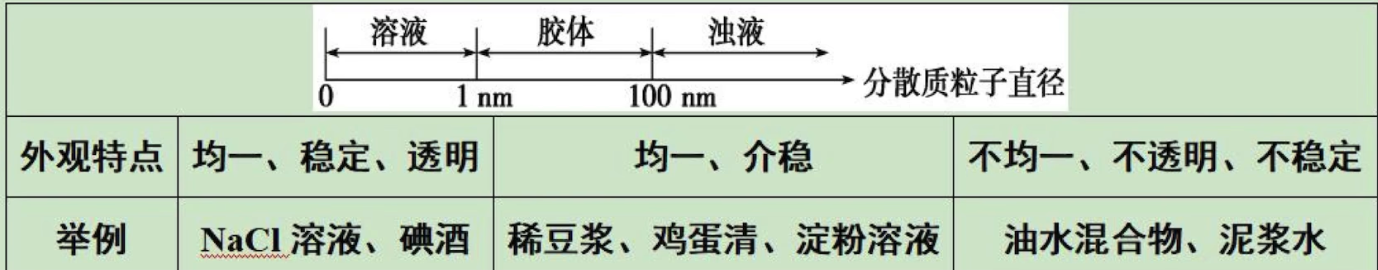
常见实例
- 溶液:食盐水、
溶液 - 胶体:
胶体、豆浆、鸡蛋清 - 浊液:石灰乳、泥沙水
离子方程式
用实际参加反应的离子符号来表示反应的式子
拆卸规律
- 单质、氧化物、气体、难溶物、弱电解质(弱酸、弱碱、水)一律写化学式
- 酸式盐
- 强酸的酸式盐:全拆,如
写成 - 弱酸的酸式盐:半拆,如
写成
- 强酸的酸式盐:全拆,如
- 三大浓酸
- 浓盐酸、浓硝酸:写离子形式
- 浓硫酸:写化学式
,因为浓硫酸浓度高到98%,几乎没有水可供电离
书写技巧
- 少量为1,先中和后沉淀
- 检查原子个数和电荷总数是否相等
离子共存
判断一:溶液颜色
当溶液无色时,有色离子不会大量共存(注意区分无色和透明)
有色离子:
判断二:溶液酸碱性条件
- 溶液呈强酸性时,与
反应的离子无法大量存在: - 氢氧根离子:
- 弱酸根离子:如
、 、 、 、 -、 、 等 - 反之,
可以和 、 、 、 、 、 等强酸根大量共存
- 反之,
- 氢氧根离子:
- 溶液呈强碱性时,与
反应的离子无法大量存在: - 氢离子:
- 铵根离子:
- 与氢氧根形成沉淀的金属阳离子:除
、 、
- 氢离子:
- 无论是强酸性还是强碱性,皆无法大量共存的离子:
- 弱酸的酸式根离子:如
、 、 、 、 、
- 弱酸的酸式根离子:如
判断三:常见的难溶物、微溶物
难溶物
与 、 与 、 、 (补充: 白色、 淡黄色、 黄色 ) 、 与 、
四大微溶物
、 、 、
判断四:离子间发生氧化还原反应不共存
判断氧化还原反应
- 在化学方程式上标出元素的化合价
- 化合价升高,代表失去电子,叫还原剂,具有还原性,发生氧化反应,得到氧化产物
- 化合价降低,代表得到电子,叫氧化剂,具有氧化性,发生还原反应,得到还原产物
口诀:杨家将——氧化剂(杨)的化合价(家)是降低(降)的
钠及其化合物
焰色反应
实验用品:铂丝或铁丝、稀盐酸、酒精灯
钠元素:黄色
钾元素:紫色
钠与氧气
常温:
加热:
钠与水
现象:浮、熔、游、响、红
- 与
反应 - 与
反应
热稳定性:
一般用来鉴别两种物质或测定一种物质的含量
氧化物
两性氧化物: